盐酸(一元无机强酸)

VLoG
次浏览
更新时间:2023-05-23
盐酸
一元无机强酸

盐酸(英文名:Hydrochloric Acid)即氯化氢的水溶液,为一元无机强酸,是一种混合物。浓盐酸为无色液体,有强烈的刺激性气味。盐酸能与水和乙醇以任意比例混溶,具有酸性、氧化性和还原性,能够与酸碱指示剂、碱、金属、金属氧化物以及盐类等发生反应。浓盐酸有强挥发性,在空气中挥发会形成白雾。盐酸是重要的实验室试剂和工业化学品,能够用于调节漂染工业、金属加工、食品加工、药品生产等领域。盐酸被纳入中华人民共和国第445号国务院令《易制毒化学品管理条例》(2005年版)中,是一种易制毒化学品。
基本信息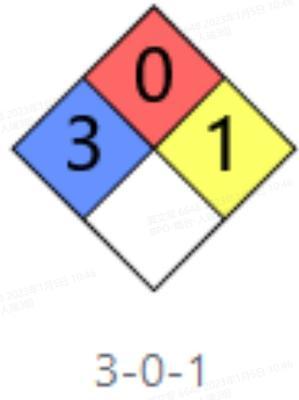
中文名
盐酸
英文名
Hydrochloric Acid
别名
氢氯酸
拼音
yán suān
CAS号
7647-01-0
性质
外观
无色至淡黄色清澈液体
气味
有刺激性气味
密度
1.05 g/cm³(质量分数10.17%,15 ℃)
熔点
-25.39 ℃(质量分数39.17%)
沸点
108.3 ℃(质量分数20.22%)
溶解性
能与水和乙醇以任意比例混溶
log P
0.25
pH值
1(HCl浓度为0.1mol/L)
危险性
NFPA 704

可燃性等级:0(不会燃烧)
稳定性等级:1(通常情况下稳定,但是可能在加热加压的条件下变得不稳定)
发现历史
1790年,英国化学家戴维(Davy)证明氢元素和氯元素组成了氯化氢。在电解食盐水时,他发现自己得到的产物除了氢氧化钠溶液,还有氢气和氯气。在同一年,法国化学家勒布朗(Leblanc)探索出了生产碳酸钠的工艺。该方法的第一步需要将氯化钠与硫酸加热制备硫酸钠,此过程产生的副产物氯化氢气体会被直接排放到空气中。
1836年,英国的化学品制造商威廉·戈萨奇(William Gossage,1799-1877)采用填充焦炭的洗涤塔回收氯化氢,此举是为了减少氯化氢气体对环境的破坏。同年英国颁布了世界上首个针对环境保护的碱工业法规,限令各工厂必须回收生产中产生的副产物氯化氢气体,工业上开始大规模产出盐酸。那些过量的不能用于制备盐酸的氯化氢气体被氧化生成氯气,作为生产漂白粉的原料。
20世纪初,氯化氢合成工艺有了极大的进步,人们通过氯碱电解工艺可以制备高纯度的氯化氢气体。且随着人们对环境保护的日益重视,专门生产氯化氢的工艺已被逐步淘汰,人们开始从氯化过程(如乙烯生产氯乙烯)及焚烧含氯废物产生的气体中回收氯化氢气体以制取盐酸。
化学性质
和酸碱指示剂反应
和碱发生中和反应
盐酸能和NaOH、Mg(OH)₂、Al(OH)₃等碱反应:



和氧化物反应




在工业中可以应用这个性质来除去金属表面的氧化层。
和氧化性酸反应
盐酸和氧化性酸反应的产物都有氯气。







和过氧化物反应
盐酸能够和过氧化物(如Na₂O₂、PbO₂)反应生成氯化物或氯气,反应方程式如下:


和盐反应







和金属反应
盐酸可以和Mg、Ca、Al等金属反应,生成盐和氢气,反应方程式如下:



和硼化物、氮化物、碳化物反应



生成配合物


与有机物反应
一般情况下,胺类化合物在水中溶解度很小,这时候可以使用稀盐酸将胺类化合物处理为铵盐从而增大他们的溶解度,反应通式如下:


根据以上反应可以把胺和其他的有机物分离。
物理性质
盐酸的物理性质,例如沸点和熔点、密度和pH值,取决于水溶液中HCl的浓度或摩尔浓度。
质量分数 | 浓度 (g/L) | 密度 (g/mL) | 物质的量浓度 (mol/L) | pH | 粘度 (mPa·s) | 比热容 KJ/(kg·K) | 蒸气压 (kPa) | 沸点 (℃) | 熔点 (℃) |
10% | 104.80 | 1.048 | 2.87 | -0.5 | 1.16 | 3.47 | 1.95 | 103 | -18 |
20% | 219.60 | 1.098 | 6.02 | -0.8 | 1.37 | 2.99 | 1.40 | 108 | -59 |
30% | 344.70 | 1.149 | 9.45 | -1.0 | 1.70 | 2.60 | 2.13 | 90 | -52 |
32% | 370.88 | 1.159 | 10.17 | -1.0 | 1.80 | 2.55 | 3.73 | 84 | -43 |
34% | 397.46 | 1.169 | 10.90 | -1.0 | 1.90 | 2.50 | 7.24 | 71 | -36 |
36% | 424.44 | 1.179 | 11.81 | -1.1 | 1.99 | 2.46 | 14.5 | 61 | -30 |
38% | 451.82 | 1.189 | 12.39 | -1.1 | 2.10 | 2.43 | 28.3 | 48 | -26 |
表中的参考温度为20 ℃,压力为1个大气压(101.325 kPa),蒸气压指溶液的总蒸气压。 | |||||||||
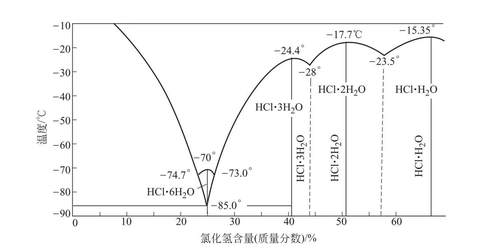
盐酸的恒沸点为108.5 ℃,下表是不同压力下的盐酸的恒沸组成。
压力/mmHg | 730 | 740 | 750 | 760 | 770 |
氯化氢质量分数/% | 20.314 | 20.290 | 20.266 | 20.242 | 20.218 |
应用领域
实验室应用
调节pH:盐酸能够中和碱液、调节溶液的pH值,具体应用:处理某些实验室废液时,可以使用盐酸调节pH使其达到排放标准;某些合成反应需要在一定的pH值下进行,可以使用盐酸进行调节,等等。
焰色反应:焰色反应可以鉴别金属离子,盐酸在焰色反应中可用来清洗铂棒避免其他离子对结果产生干扰。
酸碱滴定:盐酸可用于配置酸标准溶液。
稀有金属的湿法冶金
盐酸的反应能力强,因而可以浸出多种金属、金属氧化物以及部分硫化物,在湿法冶金中可用于浸出镍锍、钴渣等。以冶炼金属钨为例,将白钨矿和碳酸钠反应后得到的主要产物钨酸钠溶于水后,加盐酸酸化可以得到钨酸沉淀,能够将钨元素与其他杂质分离。
有机合成

漂染工业
盐酸可用于酸洗漂白后的棉布、中和棉布丝光处理后残留的碱。此外,在印染过程中,可以通过盐酸,将一些不溶于水的染料处理成可溶的盐酸盐。
金属加工
盐酸可以用于酸洗钢材,使用浓度为18%的盐酸去除钢材表面的锈或铁氧化物,可以方便接下来轧制钢材或给钢材镀锌等操作。酸洗钢材工业促进了类似喷雾焙烧炉、流化床盐酸再生这样的盐酸再生工艺的发展,这些工艺能够实现酸循环,节约能源资源。
食品工业
阳离子交换树脂再生
使用盐酸浸泡失效的阳离子交换树脂,能够使失效的阳树脂再生。
药品生产
盐酸具有两大优点:一是盐酸中的氯离子没有毒性,二是制备盐酸很简单,适合大规模生产并且价格便宜。药学中,盐酸经常被应用于药物成盐,可以极大地改变药物的物理化学性质。如可用于合成可口服头孢抗菌素头孢卡品内酯化合物盐酸盐、抗流感药物盐酸阿比朵尔、医药中间体2-(氨基)乙基甲基砜盐酸盐等。
检测方法
盐酸含量检测:可采用甲基橙作为指示剂,氢氧化钠标准溶液滴定试样,到达滴定终点的表现是溶液由红色变橙色,记录滴定使用的氢氧化钠标准溶液的体积,算出HCl的含量。
安全事项
消防相关
泄漏相关
盐酸泄漏后,人员应迅速撤离并隔离污染泄漏区。盐酸少量泄漏,可以用沙土或干石灰混合掩埋或使用大量水冲洗盐酸;盐酸大量泄漏,则需要挖坑或使用专用的容器收容,并将盐酸运送到专业的处理厂处理。
健康相关
GHS危险性类别:
项目 | 类别 |
加压气体 | 液化气体 |
皮肤腐蚀/刺激 | 1A |
急性吸入毒性 | 3 |
皮肤直接接触盐酸会被灼烧,长期接触可能会导致皮炎。
眼睛接触盐酸可能会导致视力下降或失明。
呼吸道吸入盐酸会产生刺激,可能会导致炎症和肺水肿。
口腔摄入盐酸会导致黏膜、食道和胃腐蚀,长期接触可能会腐蚀牙齿,以及引发消化系统疾病。
急救措施
盐酸接触眼睛,应立即使用清水清洗眼睛15钟,并且尽快就医。
盐酸接触皮肤,应立即用大量清水冲洗接触盐酸的皮肤15分钟,可以在皮肤上涂抹如肥皂水这样的弱碱性物质并及时就医。
呼吸道接触盐酸,立即转移至空气新鲜处,保持呼吸畅通并尽快就医。
运输相关
高纯盐酸腐蚀性极强,禁止和有毒、有害物品混运或混储,接触的人员必须穿戴好防护用具。
使用聚氯乙烯桶或陶瓷坛封装高纯盐酸时,注料口需要用螺栓盖盖住,并且要用耐酸材料封闭盖子,之后装入木箱,箱口要比注料口至少高2 cm,使用槽车及储罐进行包装时应衬胶并加密封盖。
环境相关
浓盐酸挥发性强,挥发在空气中会形成白雾,严重污染空气。


