ATP合成酶(广泛分布于线粒体内膜的蛋白酶)

VLoG
次浏览
更新时间:2023-05-23
ATP合成酶
广泛分布于线粒体内膜的蛋白酶
概述
ATP合成酶
组成
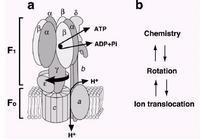
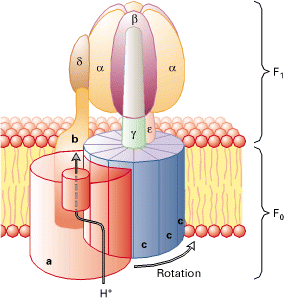
ATP合酶主要由F₁(伸在膜外的水溶性部分) 和Fo(嵌入膜内)组成(图1)。不同物种来源的 ATP合酶含的亚基和数目不尽相同。以牛心线粒体 ATP合酶为例,它的F₁含有仅α3、β3、γ、δ、ε共9 个亚基,Fo含a、b2、C10共13个亚基,F₁与Fo之间有OSCP柄相连接,还有抑制蛋白。线粒体F₁Fo-ATP酶的总分子量约为500 ku。对大肠杆菌ATP合酶的研究较为详尽,它的F₁含5种亚基α、β、γ、δ、ε,分子量分别是55.3、50.3、31.6、19.3和14.9 ku。准量关系为α3、β3、γ、δ和ε。F₁的总分子量为382 ku。Fo由a、b、c 3种亚基组成,分子量分别为30.3、17.2和8.3 ku,准量关系为a,b2,C9-12。Fo的总分子量约为164 ku,因此大肠杆菌F₁Fo一ATP酶的总分子量共为546 ku。叶绿体ATP酶由CF₁和CFo两部分组成,它们的亚基的组成和分子量与上述两种ATP合酶大体相似,但又有一定的差异。
结构
F1由5个不同的亚基组成,用化学计量法表示是α3β3γ1δε1。通过对牛F1部分的X-Ray晶体衍射分析,得到了一个很确切的结构—α3β3γ集合体。α和β亚基的三个重复结构轮流围绕在γ亚基α螺旋结构的氨基和羧基末端。此外,重要的是三个β亚基在结合核苷酸后会处于不同的状态:βT,βD和βE。β亚基的不均匀性结构与酶的接触反应部分相比,显然是一致的。
F0是由三个亚基构成,化学计量法表示是a1b2c10-12。c和a亚基的cAsp-61和aArg-210对质子迁移分别独立作用。同时提出了具有12个c亚基的环状结构,并且电子显微镜、原子粒显微镜也这样提示,而且单个c亚基的核磁共振形成的模型拥有两个跨膜α螺旋结构。
描述的是Escherichiacoli的F1F0结构。蛋白是具有两个方向的。F1部分包括α3,β3,γ,δ和ε亚基,F0部分包含a,b和c亚基,测定其化学含量比为1:2:10-14。F1和F0由两个细茎连在一起,中心的一条连接γ和ε亚基,外围的那条则旋绕δ和b亚基。在哺乳动物,通常会有额外的亚基在细茎部位。
合成和水解
ATP合成酶位置
ATP合酶在线粒体内膜上的分布不对称,数量也不相等。
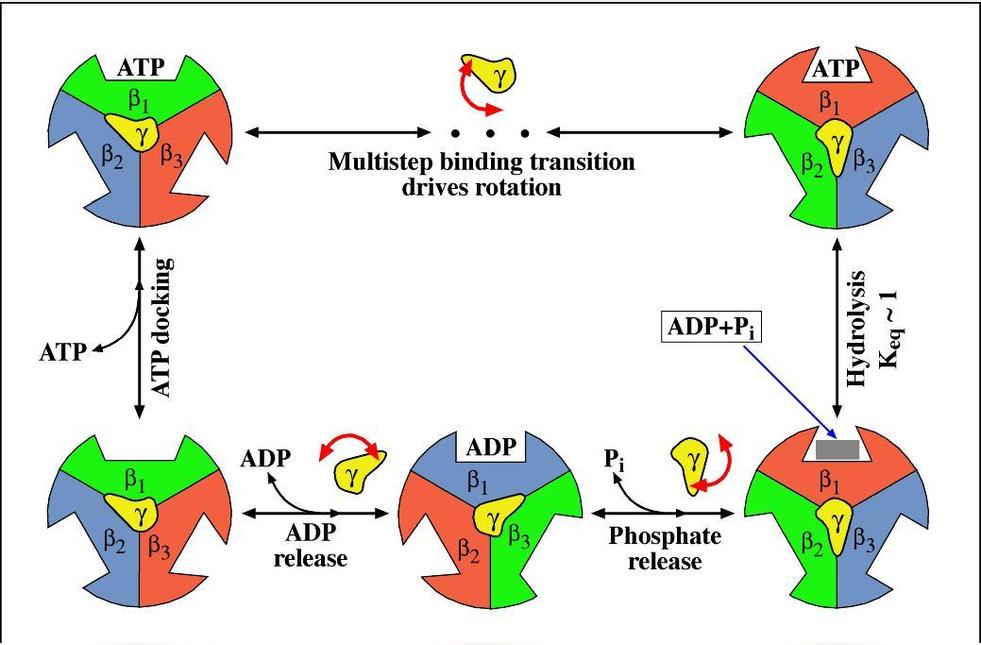
F1部分包含3个结合位点,在每一个β亚基上。当少量的ATP增加时,这些结合位点被占据,底物结合的就非常紧密并且ATP的水解发生得非常缓慢。过量的ATP则导致其可结合在所有的结合位点上,并且伴随产生的是在第二和第三个位点上具有很低的底物亲和力。且第三位点的使用率若增加,ATP的水解率则增加104~105。
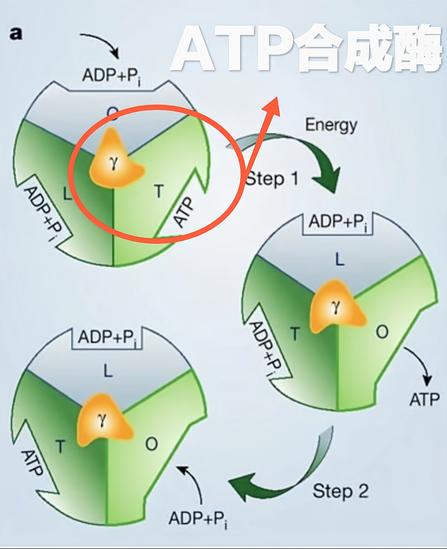
F1部分是一个有效的三倍复合体,由三个α亚基和β亚基组成,其具有与底物结合强的负协调性质,同时亦具有酶活性的正协调性质。为了解释这些特殊的部分,Boyer提出“结合导致变化”或者称为“抉择位点”的假想。这则假想的关键特征是三个结合位点,和因此由三个α和β亚基配对形成的这些位点,在任何时期有不同的信息。一个开放并且准备ATP(或者ADP+Pi)结合,而第二和第三个位点则围绕着一定的核苷酸,部分独立的开放或者关闭。ATP结合物和开放位点关闭的结果可以产生协调信息的变化,其他的两个位点也发生了改变,导致关闭的位点成为了部分开放,而部分开放的位点成为全部开放。如此,每个位点当ATP水解时,在三个状态下发生变化,在相反的过程中,即当ATP合成时,同样发生变化。一些构象调节的细节表明三组αβ配对亚基一起同时被调控,然而对于在每一时期每一位点ATP合成或者分裂过程中,其反应的中止仍然有争议。
电子显微镜研究表明在α3β3构成的环中,γ亚基具有旋转性。这在80年代就已经证明。这些分析令人信服的显示了α和β亚基围绕这个六边体发生的改变,六边体包含一个中心物质,这已经被认定是γ亚基。
F1部分,化学能促使γ亚基旋转。确切的结构揭示了γ亚基与三个β亚基分别的相互作用。与结构上的特征一致,γ亚基上的突变常常抑制ATP合成/水解,或者影响能量的配对,并且这些突变可受β亚基上的第二个突变抑制。此外,在氨基末端的突变也可受羧基端的突变抑制。类似的,羧基端的突变亦受氨基末端突变的抑制。然而这两个区域并不直接的相互作用,所观察到的现象是长距离抑制现象,这提示在催化过程中,γ亚基的构象有一个大的改变。
当β亚基在催化过程中进行一系列构象的变化时(βTβDβE)),在α3β的六边体里,γ亚基也相应的改变着构象。这种位置的改变最有可能的机制是γ亚基在六边体里自我的旋转所导致。γ亚基的旋转已经由一流的生物化学试验所提示,包括β/γ亚基的化学交联,连接γ亚基的探针漂白后偏震现象的恢复,这些均已发现。ATP水解时的旋转借助连接嗜温的杆状菌γ亚基的肌丝蛋白所记录。在这个试验当中,F1通过一个插入β亚基氨基末端的组氨酸标签固定在玻璃的表面。随着旋转,扭力发生,与生理学ATP水解释放的自由能相比,扭力接近40~50pNnm。因此,αβ3γ复合物是一个将化学能转变为机械能的有效的分子发动机。
ATP合成过程
F0旋转子的旋转机制:依赖a亚基c环的活动。与F1相比,ATP合成酶中另一个已经很好诠释的部分是F0,然而在基本的机械模型中,没有一个能够解决F0的结构。目前F0结构模型来源于核磁共振中测得的单个c亚基分子的结构,并且同时参考酵母菌F1F0复合物部分X-Ray和原子粒显微镜研究数据得出模型结构,所有的这些数据支持图1中的环状排列。对c亚基和a亚基之间的表面假设的质子通道的研究,采用了突变的研究方法,并且证实c亚基的Asp61和a亚基的Arg210是质子转移的关键氨基酸。
有的人通过实验发现来源于细菌的F1F0可以像泵质子一样泵Na+,简单的复合物研究发现当酶激活时,离子在迁移。另外通过致突变研究,去掉Na+迁移,而Li+或者H+保留;现a亚基发生了一些改变。同时也发现在这个诱导的突变中,Na+抑制了ATP的水解,这是因为钠质子通道阳离子的吸引作用。这强有力的证明了F0部分时作为一个单独的通道而起作用的。
对这个机制的任何细节上的解释显然都需要了解环上c亚基的数目,但是对其精确的测量证明是很困难的。总结以往的实验数据,c亚基的化学计量不同的种属有不同的数据,并且依赖代谢条件,同一个个体都会不同。根据X-Ray数据,酵母菌有10个c亚基。做对照,原子粒显微镜发现P.modestum和叶绿体F0各自有11和14个。
探究及问题
逻辑上很容易设想固定的部分和旋转的部分可以互换,因为F0F1没有被固定在膜上。那么F1上固定的亚基如αβ,在旋转子εγс0-12聚集时可以不动。利用与上述相仿的实验,我们检验了这个问题,发现只要εγс10-12聚集形成一个机械单位,肌丝的旋转就会观察到。借助遗传工程,将α亚基和с亚基分别连接生物素标签和组氨酸标签,这样没有化学能来获得肌丝蛋白装配的特殊性。装配到α亚基的肌丝蛋白能够在ATP水解时旋转并且产生~40pNnm的扭力。这个现象是表明F0F1是一个旋转酶的另外证据,并且α和с亚基复合物的旋转是在质子转移和ATP水解/合成之间能量耦合的必备特征。
从上述可以看出,ATP合成酶是一个毫微发电机,它可以将化学能、渗透压和机械能量互换。另外,还有一个未回答的问题是,γ和с亚基的低聚合物旋转子如何能够从F1的接触位点释放出ATP并且通过F0逆向传递质子?这需要我们进一步的研究。
前景及展望
面临的问题
(1)如何获得Fo的精细结构图像;
(2)质子通道c环与蛋白a之间的相互作用机制;
(3)质子流向与马达转向的对应切换机制;
(4)“转子”γ轴的储能机制;
(5)“定子”上的化学循环与“转子”的步进式转动之 问如何实现高效的力学化学耦合;
(6)三个催化位点顺序可逆的构象变换:βo→←βL,βL→←βT和βT→←βo,与γ近距离的相互作用关系;
(7)三个催化位点全都结合核苷才能推动马达转动 还是只需要其中两个结合;
(8)ADP和R与催化位点的结合和去结合是顺序还是随机的;
(9)催化位点聚合方向的构象变化是否有利于ADP和Pi的结合,反之。水解方向的构象变化是否有利于ATP的结合等。