氧化磷酸化(发生在真核细胞中的化学过程)

VLoG
次浏览
更新时间:2023-05-23
氧化磷酸化
发生在真核细胞中的化学过程
基本内容
偶联部位
P/O比值是指代谢物氧化时每消耗1摩尔氧原子所消耗的无机磷原子的摩尔数,即合成ATP的摩尔数。实验表明,NADH在呼吸链被氧化为水时的P/O值约等于2.5,即生成2.5分子ATP;FADH氧化的P/O值约等于1.5,即生成1.5分子ATP。
氧-还电势沿呼吸链的变化是每一步自由能变化的量度。根据ΔGO'= - nFΔE O'(n是电子传递数,F是法拉第常数),从NADH到Q段电位差约0.36V,从Q到Cytc为0.21V,从aa3到分子氧为0.53V,计算出相应的ΔGO'分别为69.5、40.5、102.3kJ/mol。于是普遍认为下述3个部位就是电子传递链中产生ATP的部位。
NADH→NADH脱氢酶→‖Q → 细胞色素bc1复合体→‖Cytc →aa3→‖O2
作用
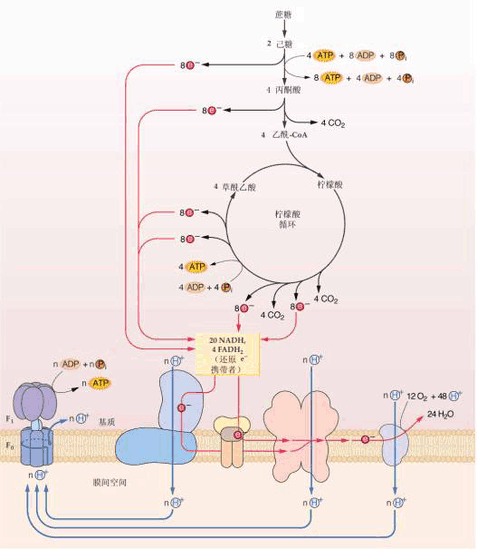
氧化磷酸化作用是指有机物包括糖、脂、氨基酸等在分解过程中的氧化步骤所释放的能量,驱动ATP合成的过程。在真核细胞中,氧化磷酸化作用在线粒体中发生,参与氧化及磷酸化的体系以复合体的形式分布在线粒体的内膜上,构成呼吸链,也称电子传递链。其功能是进行电子传递、H 传递及氧的利用,产生HO和ATP
电子传递链能承载质子和电子,将电子从供体转移到受体,并在膜间搬运质子。这些过程会使用可溶性的蛋白质结合转移分子。在线粒体中,电子在膜间隙内由水溶性电子传递蛋白细胞色素c传递。它通过其结构中血红素基团的一个铁原子的还原和氧化过程传输电子。在某些细菌的周质空间中也发现了细胞色素c。
线粒体内膜中的脂溶性电子载体辅酶Q10(Q)通过氧化还原循环,可同时携带电子和质子。这个小苯醌分子疏水性很强,所以它能自由地在膜中扩散。当Q接受两个电子和两个质子时,它被还原为“泛酚”形式(QH);当QH释放两个电子和两个质子时,它被氧化为“泛醌”(Q)形式。结果,如果安排两种酶,使得Q在膜的一侧被还原,而QH在另一侧被氧化,泛醌就能耦合这些反应,并携带质子穿过膜。除了泛醌,一些细菌在电子传递链中还使用其他的醌类,如甲萘醌。
电子传递链
真核生物的
许多生化代谢过程,如糖酵解、三羧酸循环和β氧化,都会产生还原型辅酶NADH。此辅酶含有高电极电势的电子;也就是说,它们将在氧化时释放出大量的能量。然而,细胞不会一次性释放完全部的能量,因为在这种情况下,反应将无法控制。相反,电子从NADH释放出来,并通过一系列的酶传递给氧气,其中每步只释放少量的能量。由复合体I到IV组成的这组酶称为电子传递链,存在于线粒体内膜中。琥珀酸也被电子传递链氧化,但起点不同。
真核生物中,电子传递系统中的酶用从氧化NADH释放的能量,泵送质子穿过线粒体内膜。这会使质子在膜间隙中积聚,产生跨膜电化学梯度。然后,ATP合酶使用存储在其中的势能以产生ATP。其中,真核细胞线粒体中的氧化磷酸化是这一过程研究最为透彻的样例。线粒体存在于几乎所有的真核生物中,但部分原生生物例外,如阴道毛滴虫中称为氢化酶体的残留线粒体会将质子还原为氢。
展开表格
NADH-Q还原酶,又称“NADH脱氢酶”或“复合体I”,是电子传递链中的第一个蛋白。它是一个巨大的酶,在哺乳动物中该复合体由46亚基组成,有1000千道尔顿(kDa)。目前只了解一种细菌的复合体详细结构;大多数生物的复合体酷似有一个大“球”的靴子,从膜中穿到线粒体。编码单个蛋白质的基因同时包含在细胞核和线粒体基因组中,许多线粒体酶都是这种情况。
此酶催化的反应为NADH被辅酶Q10,即线粒体膜上的一种脂溶性醌类“泛醌”(在下面公式中写作Q)所氧化,同时转移两个电子:
这个反应乃至于整个电子链,是从NADH分子与复合体I结合及放出两个电子而开始。电子通过附着在其上的黄素单核苷酸(FMN)辅基进入复合体I。电子的加入使FMN转换为它的还原形式,FMNH。电子随后通过一系列存在于复合体中的第二种辅基铁硫簇转移。复合体I中存在两种铁硫簇,[2Fe-2S]和[4Fe-4S]。
电子穿过复合体时,有4个质子从基质泵入膜间隙。尚不清楚其中的机制,但似乎与复合体I的构象改变有关,这可使该蛋白质在膜的N侧结合质子,并在P侧释放它们。最后,电子从铁硫簇链转移到膜中的泛醌分子上。泛醌的还原也有助于质子梯度的产生,因为基质中的两个质子被用于泛酚(QH)的还原。
琥珀酸-Q氧化还原酶,又称“复合体II”或“琥珀酸脱氢酶”,是电子传递链的第二个入口。它很特别,因为它是唯一一个既属于三羧酸循环、又属于电子传递链的酶。复合体II包含四个蛋白质亚基,一个附着的黄素腺嘌呤二核苷酸(FAD)辅因子,铁硫簇,和一个不参与将电子转移到辅酶Q、但被认为在降低氧化物活性上起重要作用的血红素基团。它将琥珀酸氧化为延胡索酸,将泛醌还原。该反应释放的能量比氧化NADH少,因此复合体II不运输质子穿过膜,不会影响质子梯度。
一些真核生物,如寄生虫猪蛔虫,有类似复合体II的延胡索酸还原酶(甲基萘醌:延胡索酸氧化还原酶,又称QFR),但功能相反,其氧化泛醌而还原延胡索酸。这使蠕虫可以在大肠的厌氧环境中生活,将延胡索酸作为电子受体进行厌氧氧化磷酸化。复合体II的另一种非常规功能在引起疟疾的寄生虫“恶性疟原虫”中得到体现。在这里作为氧化酶,复合体II的逆作用对泛酚的再生很重要,寄生虫将其用于一个不寻常的生物合成嘧啶的方式。
电子传递黄素蛋白-Q氧化还原酶
电子传递黄素蛋白-泛醌氧化还原酶(ETF-Q氧化还原酶),又称“电子传递-黄素蛋白脱氢酶”,是电子传递链的第三个入口。它是接收线粒体基质中电子传递黄素蛋白的电子,并用这些电子还原泛醌的酶。这种酶包含一个黄素和一个[4Fe-4S]簇,但不像其它的呼吸链复合体,它只附着在膜的表面,不跨越脂质双分子层。
哺乳动物中,该代谢途径在脂肪酸的β氧化和氨基酸及胆碱的分解代谢作用中很重要,因为它接受来自多个乙酰辅酶A脱氢酶的电子。在植物中,ETF-Q氧化还原酶也对使植物可以在长时间的黑暗中生存下来的代谢反应重要。
Q-细胞色素c氧化还原酶(复合体III)
Q-细胞色素c氧化还原酶又称“细胞色素c还原酶”、“细胞色素bc复合体”,或简称“复合体III”。在哺乳动物中,这种酶是一个二聚体,每个亚基包含11个蛋白质亚基,1个[2Fe-2S]铁硫簇和3个细胞色素:1个细胞色素c和2个细胞色素b。细胞色素是一种传输电子的蛋白,包含至少一个血红素基团。当电子通过蛋白传递时,复合体III中血红素基团内的铁原子在还原型二价铁(+2)和氧化型三价铁(+3)之间切换。
作为反应中唯一可将电子从QH供体转移到细胞色素c受体的物质,复合体Ⅲ的反应机理较其他呼吸复合物认识更为详尽,其包含两个步骤,称作Q循环。首先在第一步中,酶与三个QH底物结合,然后将其氧化,并将所产生的一个电子传递到第二个底物细胞色素C。QH所释放的两个质子被传递到膜间隙。第三个底物Q接受来自QH的第二个电子,而还原为泛半醌自由基Q。先前的两个底物被释放,但这个泛半醌中间体仍然被酶所结合。第二步中,第二个QH分子与酶结合,再一次将它的第一个电子传递给细胞色素c受体。结合的泛半醌得到第二个电子,并获得线粒体基质中的两个质子,而还原为QH。这个QH随后被酶释放。
当辅酶Q在膜的内侧还原为泛酚,而在另一面氧化为泛醌时,质子的跨膜净转移随之发生,从而增加了质子梯度。通过相当复杂的两步机制完成反应是重要的,因为它增加了质子转移的效率。如果替换Q循环,直接用一个QH分子来还原两个细胞色素c分子,则每还原一个细胞色素c只能传送一个质子,效率将会减半。
细胞色素c氧化酶(复合体IV)
细胞色素c氧化酶,又称“复合体IV”,是在电子传递链的最后一个蛋白质复合体。哺乳动物的酶有极其复杂的结构,包含13个亚基,2个血红素基团,以及多种金属离子辅因子——总计3个铜原子,1个镁原子和1个锌原子。
这种酶承载了电子传递链的最终反应,在跨膜泵送质子时将电子转移到氧上。这一步,氧作为最终电子受体,也称“末端电子受体”,被还原为水。直接泵送的质子和在氧的还原中消耗的基质中质子都能影响质子梯度。所催化的反应为细胞色素c的氧化及氧的还原:
替代的还原酶和氧化酶
许多真核生物的电子传递链中的酶与上述研究较多的哺乳动物有所不同。例如,植物有替代的NADH氧化酶,可以不在线粒体基质而在细胞质中氧化NADH,并将这些电子传递到泛醌池。这些酶不传送子,可在不改变跨膜电化学梯度时还原泛醌。
分岔电子传递链的另一个例子是“替代氧化酶”,存在于植物、一些真菌及原生生物中,一些动物也可能包含其中。这种酶可直接将泛酚中的电子转移到氧。
通过这些替代NADH和泛醌氧化酶的电子传递途径比完整路径的ATP产量低。这些捷径的优点尚不明确。然而,替代氧化酶产生于应激反应,如受寒、活性氧、病原体感染,及其他抑制完整电子传递链的因素。因此,替代途径可能可以通过减少氧化应激,从而提高生物对伤害的抵抗力。
复合体组织
原核生物的
虽然结构和功能与真核生物中的电子传递链相似,细菌和古菌的电子传递酶种类更为繁多。它们也拥有种类同样繁多的化学物质作为底物。与真核生物相同,原核生物的电子传递使用氧化底物所释放的能量泵送离子跨膜,以产生电化学梯度。细菌中,对大肠杆菌的氧化磷酸化最为了解,而古菌中的这个过程目前仍知之甚少。
真核生物和原核生物氧化磷酸化过程的主要区别是,细菌和古菌使用许多不同的物质以提供或接受电子。这使得原核生物可以在各种环境中生活。例如在大肠杆菌中,许多还原剂和氧化剂对都可以驱动氧化磷酸化,如下所示。化学物质的中点电位可以衡量其被氧化或还原时所释放的能量,其中还原剂具有负电位,氧化剂具有正电位。
展开表格
如上所示,大肠杆菌可以在有还原剂如甲酸盐、氢或乳酸作为电子供体,及硝酸盐、DMSO、或氧气作为受体的条件下生活。氧化剂和还原剂之间的中点电位差异越大,它们发生反应时就能释放更多的能量。这些化合物中,琥珀酸盐/延胡索酸盐对较特别,因为它的中点电位接近于零。琥珀酸盐因此可以在有强氧化剂的条件下氧化成延胡索酸盐,如氧,或者延胡索酸盐在有强还原剂的条件下还原成琥珀酸盐,如甲酸盐。这些替代反应分别由琥珀酸脱氢酶和延胡索酸还原酶催化。
一些原核生物使用较小中间电位差的氧化还原对。例如,硝化细菌如硝化杆菌将亚硝酸盐氧化为硝酸盐,将电子传给氧气。反应中释放的少量能量就足以泵送质子以产生ATP,但还不足以直接产生同化作用所需的NADH或NADPH。通过使用亚硝酸盐还原酶产生足够的质子动力,让电子传递链的一部分反向运行,使复合体I生成NADH,从而解决了此问题。
原核生物可变换其产生的酶,控制电子供体和受体的使用,以适应环境条件的改变。因为不同的氧化酶和还原酶都使用相同的泛醌池,使其有一定的灵活性。由共同的泛醌中间体建立联系,酶的不同组合可以一起发挥作用。呼吸链的模块化设计使其拥有多套可交换的酶系统。
胞液氧化
糖代谢中的三羧酸循环和脂肪酸β-氧化是在线粒体内生成NADH(还原当量),可立即通过电子传递链进行氧化磷酸化。在细胞的胞浆中产生的NADH ,如糖酵解生成的NADH则要通过穿梭系统(shuttle system)使NADH的氢进入线粒体内膜氧化。
α-磷酸甘油穿梭作用
胞液中的NADH在α-磷酸甘油脱氢酶的催化下,使磷酸二羟丙酮还原为α-磷酸甘油,后者通过线粒体内膜,并被内膜上的α-磷酸甘油脱氢酶(以FAD为辅基)催化重新生成磷酸二羟丙酮和FADH2,后者进入琥珀酸氧化呼吸链。葡萄糖在这些组织中彻底氧化生成的ATP比其他组织要少,1摩尔G→30摩尔ATP。
苹果酸-天冬氨酸穿梭作用
主要存在肝和心肌中。1摩尔G→32摩尔ATP
偶联机制
化学渗透假说
(chemiosmotic hypothesis)
1961年,英国学者Peter Mitchell提出化学渗透假说(1978年获诺贝尔化学奖),说明了电子传递释出的能量用于形成一种跨线粒体内膜的质子梯度(H+梯度),这种梯度驱动ATP的合成。这一过程概括如下:
1.NADH的氧化,其电子沿呼吸链的传递,造成H 被3个H 泵,即NADH脱氢酶、细胞色素bc1复合体和细胞色素氧化酶从线粒体基质跨过内膜泵入膜间隙。
2.H 泵出,在膜间隙产生一高的H+ 浓度,这不仅使膜外侧的pH较内侧低(形成pH梯度),而且使原有的外正内负的跨膜电位增高,由此形成的电化学质子梯度成为质子动力,是H+ 的化学梯度和膜电势的总和。
3.H 通过ATP合酶流回到线粒体基质,质子动力驱动ATP合酶合成ATP。
ATP合酶
ATP合酶由两部分组成(Fo-F1),球状的头部F1突向基质液,水溶性。亚单位Fo埋在内膜的底部,是疏水性蛋白,构成H+ 通道。在生理条件下,H+ 只能从膜外侧流向基质,通道的开关受柄部某种蛋白质的调节。
ATP合酶,又称“复合体V”,是氧化磷酸化途径中的终点酶。无论在原核生物还是真核生物中,这种酶的形式和作用方式都相同。它用存储在跨膜质子梯度的能量,驱动ADP和磷酸盐(P)合成ATP。合成一个ATP分子所需的质子数估计为为3至4个,有人认为细胞可以调节这一比例以适应不同的条件。
这个磷酸化反应是个可逆反应,可以通过改变质子动力变换反应方向。在不存在质子动力时,ATP合酶的反应将向左运行,水解ATP及将质子从基质中跨膜泵出。然而当存在高质子动力时,反应将被强制反向进行;反应从左向右进行,允许质子顺浓度梯度流下,将ADP转化为ATP。事实上,与此密切相关的液泡型H +-ATP酶可通过泵送质子和水解ATP,从而酸化细胞区室。
ATP合酶是一个巨大的蛋白质复合体,呈蘑菇状。哺乳动物的酶复合体包含16个亚基,质量约为600千道尔顿。嵌入在膜中的部分称为F,包含一个c亚基环和质子通道。柄和球形头部称为F,是ATP的合成位点。F端部的球形复合体包含两种不同的六个蛋白(3个α亚基和3个β亚基),而“柄”包括一个蛋白:γ亚基,柄的前端延伸到球的α和β亚基。α和β亚基都可与核苷酸结合,但只有β亚基可催化ATP的合成反应。与F部分的一侧接触并延伸到膜背面的是一个长杆状的亚基,将α和β亚基固定在酶的基底上。
当质子穿过ATP合酶基底的通道跨膜时,F上的质子驱动马达随之旋转。转动的原因可能是由于c亚基环上的氨基酸电离变化,引起静电相互作用,从而推动c亚基环旋转。旋转的环反过来驱动α和β亚基内的中心轴(γ亚基柄)旋转。作为定子的α和β亚基被侧臂固定以防止自身发生旋转。在由α和β亚基组成的球内,γ亚基顶部的运动为β亚基的活性部位提供了能量,使其周期性地产生并释放ATP。
此ATP的合成反应称为结合能力机制,其中涉及β亚基活性位点在三种状态之间的循环。在“空置”态,ADP和磷酸根进入活性位点(图中棕色所示)。然后蛋白质包围这些分子,并与之松散结合——是为“疏松结合”态(红色所示)。随后,酶再次改变形状,迫使这些分子结合在一起,在随后的“紧密结合”态(粉色所示)中,活性位点与新产生的极高亲和力ATP分子结合。最后,活性位点循环回空置态,释放出ATP并再次结合ADP和磷酸根,准备下一个循环。
在一些细菌和古菌中,ATP的合成是由钠离子的跨细胞膜移动所驱动,而不是质子的移动。古菌如甲烷球菌也包含AA合酶,其包含额外的蛋白质,亚基顺序与其他细菌和真核生物ATP合酶不相类似。也许在一些物种中,AA的酶是一种特殊的钠驱动ATP合酶,但可能在其他情况下并不总是正确的。
活性氧物质
氧分子是强氧化剂,因而是一种理想的末端电子受体。但氧的还原过程涉及有潜在危害的中间体。虽然四个电子和四个质子的转移而将氧还原为水的反应是无害的,一个或两个电子的转移会产生超氧或过氧阴离子,这是危险的反应。
细胞色素c氧化酶复合体能高效地将氧还原为水,且只释放极少量的部分还原中间体;然而,电子传递链却会产生少量的超氧阴离子和过氧化物。其中尤为重要的是辅酶Q在复合体III中的还原过程,因为作为一种中间体,高活性的泛半醌自由基会在Q循环中生成。这种不稳定的物质可能会导致电子的“泄漏”,从而直接将电子传递到氧,形成超氧化物。由于在高膜电位时,这些质子泵复合物生成活性氧物质的速度最快,有人认为线粒体能调节自己的活动,使膜电位维持在一个狭窄的范围内,以此平衡氧化剂和ATP的生成。例如,氧化剂可以激活解偶联蛋白,从而降低膜电位。
影响因素
解偶联剂
2,4-二硝基苯酚(DNP)和颉氨霉素可解除氧化和磷酸化的偶联过程,使电子传递照常进行而不生成ATP。DNP的作用机制是作为H 的载体将其运回线粒体内部,破坏质子梯度的形成。由电子传递产生的能量以热被释出。
ADP调节作用
正常机体氧化磷酸化的速率主要受ADP水平的调节,只有ADP被磷酸化形成ATP,电子才通过呼吸链流向氧。如果提供ADP,随着ADP的浓度下降,电子传递进行,ATP在合成,但电子传递随ADP浓度的下降而减缓。此过程称为呼吸控制,这保证电子流只在需要ATP合成时发生。
历史
对氧化磷酸化的研究起源于阿瑟·哈登1906年的报告,阐述了磷酸盐在细胞发酵中的重要作用,但最初只知道糖磷酸盐与此相关。然而在20世纪40年代初,糖的氧化和ATP的生成之间的联系被赫尔曼·卡尔卡牢牢确立,同时在1941年,弗里茨·阿尔伯特·李普曼确认ATP在能量传递中起核心作用。后来在1949年,莫里斯·弗里德金与阿尔伯特·伦宁格证明,辅酶NADH与代谢途径如三羧酸循环及ATP的合成有关。
又过了二十年,ATP的生成机制依然是个谜,同时科学家也在寻找那个难以捉摸的连接氧化与磷酸化反应的“高能中间体”。这个难题在彼得·米切尔于1961年发表的化学渗透理论中得到了解决。起初,这个看法极具争议,但随时间流逝,它逐渐为人们所接受,米切尔也于1978年获颁诺贝尔物理学奖。随后的研究集中于提纯和描述所涉及的酶,其中戴维·格林和埃夫拉伊姆·莱克分别对电子传递链上复合体和ATP合酶的研究作出了重大贡献。解决ATP合酶机制的关键步骤由保罗·博耶1973年构想的“结合变构”机制所解释,随后是1982年他提出的旋转催化的激进想法。较近期的工作包括由约翰·沃克完成的氧化磷酸化酶的结构研究。沃克和博耶于1997年被授予诺贝尔化学奖。


