碳正离子(带正电的不稳定有机物)

VLoG
次浏览
更新时间:2023-05-19
碳正离子
带正电的不稳定有机物
基本信息
| 中文名 | 碳正离子 |
| 外文名 | Carbenium ion |
| 释义 | 带正电的不稳定的有机物 |
| 结构 | 平面结构 |
| 特点 | 最外层有6个电子 |
发现历史
碳正离子(Carbenium ion)的历史可追溯到1891年,G. Merling说他将溴加到环庚三烯(cycloheptatriene)上,然后加热结晶化产物取得水溶性物质CHBr,产生一个他无法解释的结构.然而, Doering 跟Knox预测是符合Hückel's 规则的溴化环庚三烯的芳香族来解释这个现象. 1902年,Norris 跟Kehrman分别发现无色的三苯基甲醇在浓硫酸中会变成深黄色.相似地,三苯基氯甲烷会跟铝、锡氯化物形成有机复合物.同年,Adolf von Baeyer认为其化合物形成一个类似盐类的构造.Adolf猜测颜色跟盐类结构之间的关系就好比孔雀石绿(malachite green). 碳阳离子在许多有机反应中扮演中间物的角色.其概念最早由Julius Stieglitz于1899年发表,Hans Meerwein在他于1922做的研究Wagner-Meerwein rearrangement(重排)(瓦格奈尔-麦尔外因重排)对其概念有更深的发展.且碳正离子在S1,E1及重组反应(如Whitmore 1,2 转移)中被发现有参与反应进行.很长的一段时间,美国的化学家不愿意去接受一个新的化学概念,在文章中也不去提到碳正离子此概念.
第一个溶液中稳定的碳正离子的NMR图谱在1958年时由Doering等人所发表.其为七甲基苯离子(heptamethylbenzenium ion),由六甲基苯加上氯化铝、氯甲烷所制成.Story等人于1960制备出稳定的7-norbornadienyl阳离子,借由norbornadienyl chloride与-80℃下溶于液态二氧化硫的四氟硼酸银反应产生.此NMR图谱显示出一个非传统的中间物(第一个发现的非传统稳定离子) 1962年,Olah借由核磁共振直接发现三级丁基碳阳离子跟溶于魔酸(magic acid)里的三级丁基氟一样稳定.Norbornyl阳离子的NMR图谱最先由 Schleyer等人发表,而Saunders等人则显示出屏障间质子抢夺的过程.
结构
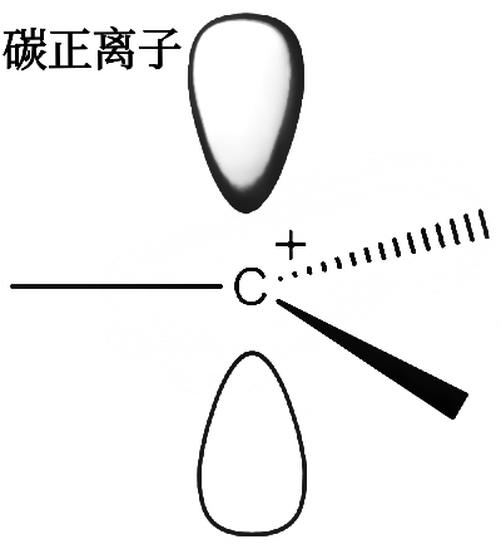
碳正离子与自由基一样,是一个活泼的中间体。碳正离子有一个正电荷,最外层有6个电子。带正电荷的碳原子以sp 杂化轨道与3个原子(或原子团)结合,形成3个σ键,与碳原子处于同一个平面。碳原子剩余的P轨道与这个平面垂直。碳正离子是平面结构。
1963年有报道,直接观察到简单的碳正离子,证明了它的平面结构,为它的存在及其结构提供了实验依据。
根据带正电荷的碳原子的位置,可分为一级碳正离子,二级碳正离子和三级碳正离子。
碳正离子的结构与稳定性直接受到与之相连接的基团的影响。它们稳定性的一般规律如下:
(2)其它碳正离子是: ;
;

(可以用超共轭解释不同碳正离子的稳定性)
碳正离子越稳定,能量越低,形成越容易。
碳正离子根据结构特点不同可分为:经典碳正离子和非经典碳正离子
形成过程
反应
种类
碳鎓离子被归类为伯,仲,或叔碳正离子,取决于结合到离子化的碳的碳原子的数目是否为1,2或3。
Alkylium离子
鎓离子


三苯甲基阳离子
Arenium离子
一个arenium离子是显示为在一个反应中间体一环己二烯基阳离子电芳香取代。由于历史原因,这种复杂的也被称为韦兰德中间体,或σ络合物。两个氢原子在垂直于苯环键合到一个碳位于一个平面内的arenium离子不再是一个芳香物质;然而它是由于离域相对稳定:正电荷经由离域超过5个碳原子的π系统。
Acylium离子
一个acylium离子是与式RCO阳离子。的结构被描述为 。它是合成的和反应性当量的酰基碳阳离子的,但实际的结构具有的氧和碳通过三键连接。这些物种是常见的活性中间体,例如,在弗里德尔-克拉夫茨酰化也在许多其他有机反应。
。它是合成的和反应性当量的酰基碳阳离子的,但实际的结构具有的氧和碳通过三键连接。这些物种是常见的活性中间体,例如,在弗里德尔-克拉夫茨酰化也在许多其他有机反应。














