氟锑磺酸(超强酸之一)

VLoG
次浏览
更新时间:2023-05-19
氟锑磺酸
超强酸之一
无色透明的粘稠液体

氟锑磺酸[化学式:HSbF5(OSO2F)或SbF5·HSO3F,式量:316.82]又称魔酸。无色透明的粘稠液体,含杂质时为淡黄色、棕色甚至是黑绿色。有明显的刺激性气味,纯净的氟锑磺酸密度大致为3.61-3.82g/ml,无固定熔沸点。电导率1.2×10-8S/m。当质子酸路易斯酸混合时,其酸的强度增大。典型的代表是氟磺酸与五氟化锑两者以1:1(mol)的混合体系,被称为魔酸。在室温下为无色透明的黏稠状液体,它是除氟锑酸外最强的酸。在魔酸中几乎所有的有机化合物都可以发生离子化。魔酸组成之一的SbF5为无色黏稠状液体,与湿气接触产生白烟,是一种非常强的路易斯酸,能与多种化合物形成加成产物。用作无机溶剂。
基本信息
| 中文名 | 氟锑磺酸 |
| 外文名 | Magic Acid |
| 化学式 | SbF5·HSO3F |
| MDL号 | MFCD09039262 |
| 腐蚀性 | 极强 |
展开
化学性质
氟锑磺酸
氟锑磺酸还是一种良好的溶剂和腐蚀剂,可以将包括金、铂在内的极不活泼金属氧化溶解。氟锑磺酸通常储存在聚四氟乙烯的容器内。在室温下氟锑磺酸和玻璃作用剧烈,并能溶解烃类有机物,可以将有机含氧化合物脱水炭化,但和含铅塑料玻璃(一种状似玻璃的透明有机含铅有机材料,主要成分是全氟聚苯乙烯、聚四氟乙烯、和二氟化铅,如图所示)反应很慢,故一般用含铅塑料玻璃制成的细口瓶盛装。
氟锑磺酸酸使某些很难质子化的物质(如高氯酸)质子化,进一步制备含有-ClO3基团的有机物:
HClO4+H+====[H2ClO4]+
[H2ClO4]++H+====[ClO3]++[H3O]+
C6H6+[ClO3]+====[C6H6ClO3]+
[C6H6ClO3]+-H+====C6H5ClO3
氟锑磺酸酸使高级烷烃质子化,催化烷烃裂解:
(CH3)3CH+H→(CH3)3C+H2;
(CH3)4C+H→(CH3)3C+CH4
R-OH+2H=R+(碳正离子)+[H3O]+
强氧化剂:Sb(V)氟化物例如SbF5具有一定的氧化性,加上它超强的酸性,大大增加了氧化能力,能够氧化腐蚀多种金属。要注意的是,氟锑磺酸是无水体系,当氟锑磺酸与大量水混合时发生强烈反应,失去超酸性。
物理性质
化学性质
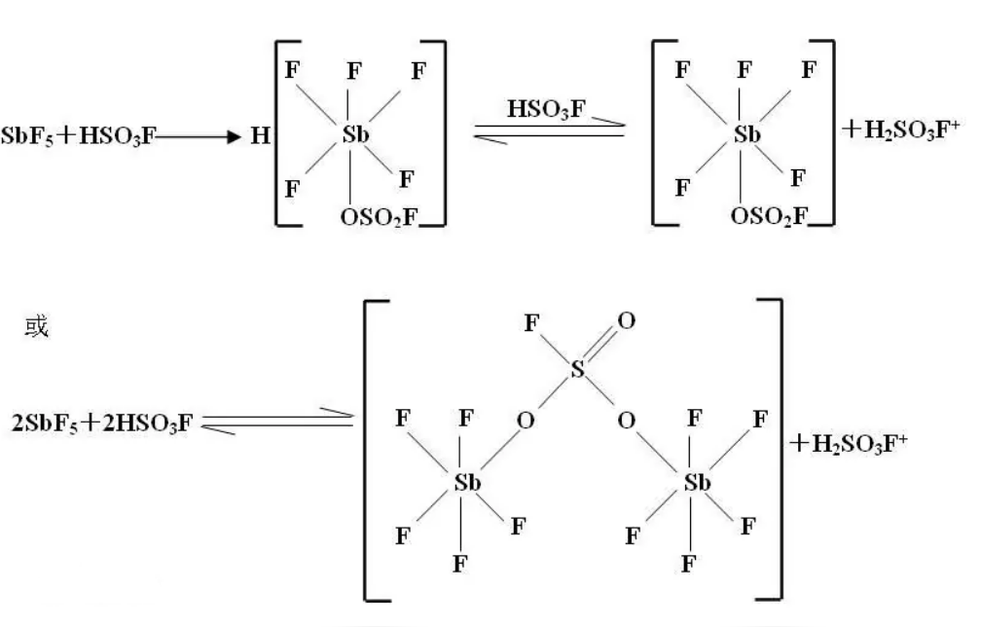
氟锑磺酸是超强酸之一,可以看作五氟化锑和氟硫酸的混合物,SbF5与FSO3-离子结合成[SbF5(OSO2F)]-离子,使电离出的氢离子几乎不受粒子引力控制。
氟锑磺酸酸性极强,以至于高氯酸、在其中都会被质子化:
HClO4+HSbF5(OSO2F)====[SbF5(OSO2F)]-+[H2ClO4]+
在这种酸性环境下,一般情况下很多无法进行的有机化合反应可以顺利进行。故氟锑磺酸常作为现代化工合成反应的催化剂。
超强酸能向链烷烃供给质子,使其质子化形成碳正离子。
R3CH+[H2SO3F]+<---->[R3CH2]++HSO3F<---->H2+[R3C]++HSO3F
超强酸对链状卤素和硫阳离子的研究提供了一个优良的溶剂介质。
氟锑磺酸酸使某些很难质子化的物质(如高氯酸)质子化,进一步制备含有-ClO3基团的有机物:
HClO4+H+====[H2ClO4]+ [H2ClO4]++H+====[ClO3]++[H3O]+ C6H6+[ClO3]+====[C6H6ClO3]+
[C6H6ClO3]+-H+====C6H5ClO3

氟锑磺酸
(CH3)3CH+H→(CH3)3C+H2;
(CH3)4C+H→(CH3)3C+CH4
氟锑磺酸酸含有羟基的有机物(如醇、酚、羧酸等)质子化,进一步脱羟基化。
R-OH+2H=R+(碳正离子)+[H3O]+
发现过程
1966年圣诞节,美国Case Western Keserve大学,G.A.Olah教授实验室一位研究人员J.Lukas无意中将圣诞节晚会上用过的蜡烛扔进一个酸性溶液(SbF5·HSO3F)中,结果发现蜡烛很快地溶解了,促使他进一步研究,此实验溶液去做核磁共振研究(14C-NMR),令人惊奇的是核磁共振谱图上竟出现了一个尖锐的特丁基阳离子(碳正离子)峰。这种酸能溶解饱和烃。从那时起,Olah实验室人员就给SbF5·HSO3F起个绰号叫“魔酸”(Magicacid)。现在人们习惯地将酸强度超过100%H2SO4的一个酸或酸性介质叫做超酸(或超强酸),把SbF5·HSO3F称作魔酸。也就是后来所说的超强酸。超强酸不但能溶解蜡烛,而且能使烷烃、烯烃等发生一系列化学变化,这是普通酸难以做到的。例如,正丁烷在超强酸的作用下,可以发生C—H键的断裂,生成氢气;发生C—C键的断裂,生成甲烷;还可以发生异构化反应生成异丁烷。在奥莱教授和他的学生这一发现的启示下,迄今为止,科学家们已经找到多种液态和固态的超强酸。液态的有HF·SbF5、TaF5·HSO3F等。固态的有SbF6·SO2ZrO、SbF5·SiO2·Al2O3等,它们都有类似于SbF5·HSO3F的性质。
应用价值
目前,超强酸在化学和化学工业上,极有应用价值,它既是无机及有机的质子化试剂,又是活性极高的催化剂。过去很多在普通环境下极难实现或根本无法实现的化学反应在超强酸环境中。却能异常顺利地完成。而由于超强酸的酸性和腐蚀性强的出奇,所以过去一些极难或根本无法实现的化学反应,在超强酸的条件下便能顺利进行。比如正丁烷,在超强酸的作用下,可以发生碳氢键的断裂,生成氢气,也可以发生碳碳键的断裂,生成甲烷,还可以发生异构化生成异丁烷,这些都是普通酸做不到的。
可以预料,随着这些具有超常酸性和腐蚀性超强酸的相继问世,化学和化学工业将会迅速走进新时代。
以下的资料是以哈米特酸度函数作为依据(哈米特酸度函数(H0)是一种用于衡量高浓度酸酸性的指标,包括超强酸。它是由物理有机化学家路易斯·普拉克·哈米特(LouisPlackHammett)建议使用的,这也是最著名的酸度函数,它对于超出pH值范围的情况是很有用的。H0每减小一个单位,即表示酸性增强10倍。),哈米特酸度函数以大负数H0值表示:
氟锑酸(1:1)(1990)(H0=−28)
魔酸(五氟化锑合氟磺酸(1:1),简称氟锑磺酸)(1974)H0=-25)
碳硼烷酸(1969)(H0=−18.0)
氟磺酸(1944)(H0=−15.1)
三氟甲磺酸(1940)(H0=−14.6)
纯高氯酸(H0=-13.0)
纯硫酸(H0=-11.93)
氯化氢(H0=−8.0)
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:1
3.氢键受体数量:9
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积62.8
7.重原子数量:11
8.表面电荷:0
9.复杂度:130
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:2
贮存方法
密闭,-20℃冷冻环境保存,最好是真空环境。
超强酸介绍
魔酸(五氟化锑合氟代磺酸,简称氟锑磺酸)的酸性是公认的最强的,值得注意的是魔酸是混合物,由HSO3F与SbF5的混合配置而成的,另外含氧酸的确切定义是由O、H与一中心原子组成的可自主电离出质子的物质,其酸性最强的配置比为HSO₃F:SbF5=2:98(摩尔比)这才是真正人们所说的魔酸。如果你学了配位化学就会明白魔酸酸性强的原因了。
其酸性强的机理:首先HSO₃F(氟磺酸,或单氟硫酸)的酸性本身比HClO₄强,不过在水溶液中由于拉平效应它们的水溶液酸性强度是一样的(就像浓度一样的硝酸溶液和盐酸溶液酸性一样,我们一般认为HNO3与HCl的酸性是不可区分的,但事实上不是),在HSO3F电离出H+后由于O、F强拉电子作用(诱导效应)使负电荷电荷较均匀的分布于整个离子,减弱了质子对阴离子团的库仑力使质子能更好的电离出去。
然后是SbF5的作用,(SO3F)-中由于存在S→O的配位键使O上带较明显的负电SbF5中由于F对Sb的诱导效应,使Sb带较强的正电性且Sb上存在一个5p空轨道(为强Lewis酸)正好可以与(SO3F)-中的O上的孤电子对形成较强的配位键就是说存在S→O→Sb,这样负电荷就扩散到了更大区域,并且受到了SbF5基团对负电荷的很好屏蔽,最多(SO3F)-可以与3个SbF5配合,不过配合度越低越稳定,因为SbF5基团太大互相抵触,(SO3F)-不能更好与太多的SbF5很好配合,因而可以解释魔酸中SbF5的量相当大,这样H+对该配合物基本不存在库仑力了所以H+变得相当自由甚至可以“趴在”电子云密度相对较大的C-H键上形成二电子三中心键很不稳定易分解生成碳正离子与H2。


