氧(化学元素)

VLoG
次浏览
更新时间:2023-05-23
氧
化学元素
基本信息
中文名
氧
英文名
oxygen
拼音
yang
元素符号
O
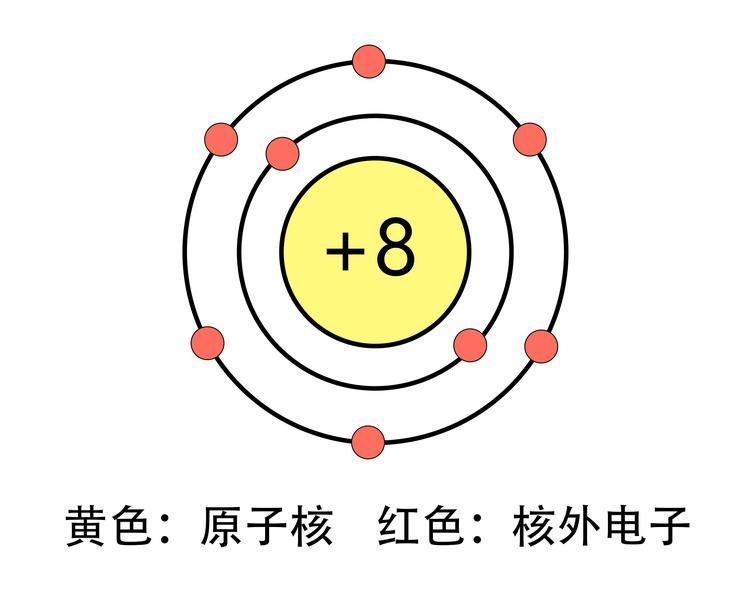
原子序数
8
原子质量
15.999
元素类别
非金属元素
族
VI A族
周期
第二周期
区
p区
电子排布
[He]2s2p
CAS编号
17778-80-2
物理性质
物态
气态
熔点
54.36K
沸点
90.18777777777778K
熔化热
0.44 kJ/mol
汽化热
6.78 kJ/mol
水溶性
0.044 g/(100g水)
原子性质
氧化态
-2,-1,+1,+2
电负性
3.44(鲍林标度)
原子半径
152 pm (范德华)
发现历史
氧元素的发现与确立最早和燃烧过程有关。1703年,德国化学家施塔尔(G.E.Georg Ernst Stahl)结合前人关于燃烧的研究提出了“燃素说”,他认为燃烧的本质是由于燃素的存在。
1771年,卡尔·威尔海姆·舍勒(Carl Wilhelm Scheele)再一次独立的发现了氧气,此次他将它称之为“火焰空气”。
1777年,法国化学家拉瓦锡通过实验也产生了氧气,并对该气体的性质进行了研究,通过结合其他化学家的见解及理论,提出了燃烧的氧化学说,推翻了燃素说,但是他错误地认为氧气是形成所有酸所必需的组成部分,因此他采用古希腊语中的酸(oxys)和形成(genes)来命名这种气体,称之为氧(oxygen)。
1860年前后,比利时分析化学家斯塔,J-S(Jean-Servais Stas)用十多年的时间对原子质量进行了精密的测定,推翻了“一切元素的原子质量都是氢原子质量的倍数”的假说,提出了采用氧原子质量为16.000作为原子质量的标准。
分布情况
氧是地壳中最丰富的、分布最广的元素,它在地壳中基本上是以氧化合物(如二氧化硅、硅酸盐及含氧酸盐等)的形式存在,在整个地壳中的质量分数为48.6%。在大气中主要以氧单质(氧气和臭氧)的形式存在,约占整个大气体积的21%,大气质量的23%。在海洋、江河以及湖泊中主要以水的形式存在,质量分数约为88.8%。此外,氧在人体和动物中质量占比约为65%。
理化性质
物理性质
氧(Oxygen)是一种非金属化学元素,元素符号为“O”,在元素周期表中的原子序数是8,为第二周期第VI A族p区元素,相对原子质量是15.999,范德华原子半径是152 pm,标准状况下呈气态,熔点是54.36 K,沸点是90.188 K。氧在宇宙中的含量仅次于氢和氦,是第三丰富的元素。氧有氧气(O2)和臭氧(O3)两种单质,还以硅酸盐、氧化物及其他含氧阴离子的形式存在于自然界中。
化学性质
氧的电子排布为[He]2s2p,氧化态有-2、-1、+1、+2。氧的电负性仅次于氟,只有与氟化合时氧化态才为正值。氧是一种高反应性元素,非常活泼,大多数化学元素都能与氧直接或间接地化合,生成各类氧化物,自然界中最丰富的二元氧化物是水和二氧化硅。氧还是动植物和人体呼吸及大多数燃烧过程所必需的元素。
氧的化学性质主要表现为氧化性,主要通过氧的单质来体现。比较氧单质的电极电势可看出O3是比O2更强的氧化剂,臭氧无论在酸性或碱性条件下都比氧气具有更强的氧化性,臭氧是最强的氧化剂之一。




- 与化合物直接反应:在常温下,氧能与化合物直接作用。如:


同位素
氧已发现的同位素有十六种,其中稳定型的同位素只有三种,分别为氧-16(O)、氧-17(O)和氧-18(O)。自然界中的氧是这三种同位素的混合物,其中O的含量最高,约占自然界中氧原子数的99.76%。O可以通过水的分馏以重氧水的形式富集,也可以在商业上使用,比如水(H2O含有15%的O)。
氧同位素的原子质量、半衰期以及发现时间
同位素符号 | 原子质量和不确定度(u) | 半衰期和不确定度(u) | 发现年份 |
O | 11.051249828 ± 0.000064453 | 198 ys ± 12(1 ys = 10s) | 2019 |
O | 12.034367726 ± 0.000012882 | 8.9 zs ± 3.3(1 zs = 10s) | 1978 |
O | 13.024815435 ± 0.000010226 | 8.58 ms ± 0.05(1 ms = 10 s) | 1963 |
O | 14.008596706 ± 0.000000027 | 70.621 s ± 0.011 | 1949 |
O | 15.003065636 ± 0.000000526 | 122.266 s ± 0.043 | 1934 |
O | 15.99491461926 ± 0.00000000032 | 稳定型 | 1919 |
O | 16.99913175595 ± 0.00000000069 | 稳定型 | 1925 |
O | 17.99915961214 ± 0.00000000069 | 稳定型 | 1929 |
O | 19.003577969 ± 0.00000283 | 26.470 s ± 0.006 | 1936 |
O | 20.004075357 ± 0.00000095 | 13.51 s ± 0.05 | 1959 |
O | 21.008654948 ± 0.000012882 | 3.42 s ± 0.10 | 1968 |
O | 22.009965744 ± 0.000061107 | 2.25 s ± 0.09 | 1969 |
O | 23.015696686 ± 0.000130663 | 97 ms ± 8 | 1970 |
O | 24.019861000 ± 0.000177 | 77.4 ms ± 4.5 | 1970 |
O | 25.029338919 ± 0.000177225 | 5.18 zs ± 0.35 | 2008 |
O | 26.037210155 ± 0.000177081 | 4.2 ps ± 3.3(1 ps = 10 s) | 2012 |
同素异形体
氧气(O2):氧气是一种无色、无味的气体,其分子式由两个氧原子构成,是氧在自然界中的主要存在形式。O2不可燃,是一种助燃剂,一些不会在空气中燃烧的材料会在氧气中燃烧,并且在空气中燃烧的材料在氧气中会燃烧得更剧烈。O2还是维持生物体呼吸的不可或缺的组分。
臭氧(O3):臭氧是一种淡蓝色的,具有特征性气味的气体,其分子式由三个氧原子构成,属于O2的同素异形体。O3是由太阳对大气中氧气的紫外线辐射作用而产生的,主要存在于高层大气中。O3具有很强的氧化能力,在常温下可以将汞和银氧化成氧化汞和氧化银,也可以使靛蓝、石蕊等染料褪色。O3是一种抗菌剂,可用于生产瓶装水,以及处理肉类、家禽和其他食品,也可用来漂白面粉、油类及纺织物,消毒饮料水、空气和病房等,还可作为示踪剂、亲电试剂、诱变剂、氧化剂和防腐剂。
化合物
其他化合物:主要有蛋白质、脂肪、碳水化合物、硅酸盐以及含氧酸盐等所有含有氧元素的化合物。
制备方法
实验室制法
- 加热分解盐:



- 加热分解重金属氧化物,如汞、银等重金属的氧化物加热就会失去氧:



- 金属过氧化物与水或酸反应:



- 电解水:

工业制法
工业上的氧主要是从空气中制取,以空气为原料,将氧组分及氮组分分离而得到氧,根据氧、氮组分分离所采取的方法不同,可以划分为低温分离空气法、变压吸附法以及膜分离法。
- 低温分离空气法:根据热力学原理采用物理方法将空气压缩、冷却液化,然后按照氧和氮组分的沸点不同(在大气压下氧的沸点约为90 K,氮的沸点约为 77 K),经多级分馏以及质、热交换,低沸点的氮组分不断地浓集于蒸气相之中,而高沸点的氧组分不断地从蒸气中冷凝聚集在液相之中,使得蒸气相中氮组分含量不断提高,液相中氧组分含量越来越高,从而使氧、氮分离。该方法所有操作均是在120 K 以下的温度条件下进行的,故称为低温分离空气法。该方法产量大且纯度高,耗能低,是世界应用最广泛的制氧方法。
- 膜分离法:利用有机聚合膜的渗透选择性,从气体混合物中分离出富氧气体。理想的聚合膜材料应具有优异的选择性和渗透性。该方法装置简单,操作方便,但是成本太高。
光合作用
绿色植物的光合作用可以将水和二氧化碳转化为氧气和碳水化合物,从而使得氧在自然界中循环利用:

应用领域
氧是一种高反应性元素,是生物体和燃烧过程所必需的元素。高压氧流可以除去生铁中的杂质用于生产钢铁,也可以与乙炔(C2H2)作用产生用于焊接的极热火焰。液氧与液氢结合可用作极好的火箭燃料。臭氧在地球周围形成一层薄薄的保护层,保护地球表面免受太阳紫外线辐射。氧气用于支持动植物呼吸和燃烧过程。
氧的稳定同位素的分子、原子和离子具有略微不同的物理和化学性质,它们通常会在物理、化学和生物过程中被分化,从而导致同位素丰度和原子量的变化。这些变化有助于调查物质的起源和研究环境、水文和地质过程。氧的同位素与氢同位素组成相结合,还可用于研究地下水与地表水(例如湖泊,溪流和河流)之间的相互作用。
O可以用于确定迁徙野生动物的起源地和繁殖地以及确定考古中人类生活居住的地理区域,还可作为示踪原子用于化学反应机理的研究。


