乳糖(一种由葡萄糖和半乳糖组成的二糖)

VLoG
次浏览
更新时间:2023-05-19
乳糖
一种由葡萄糖和半乳糖组成的二糖
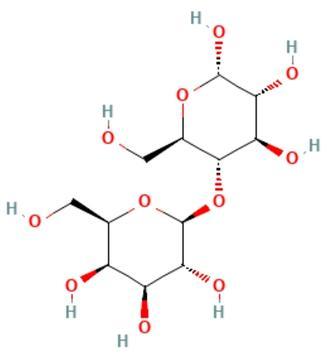
乳糖(Lactose)是一种由葡萄糖和半乳糖以β-1,4糖苷键结合而成的二糖,又名1,4-半乳糖苷葡萄糖,化学式为C₁₂H₂₂O₁₁,摩尔质量为342.30 g/mol,外观呈白色结晶粉末,无特殊气味,有甜味,具有右旋光性。乳糖有两种同分异构体,即α-乳糖和β-乳糖,α-乳糖密度为1.547 g/cm³(20 ℃),易溶于水,不溶于乙醇、乙醚、氯仿、甲醇;β乳糖密度为1.59 g/cm³(20 ℃),易溶于水,微溶于乙醇,不溶于乙醚、氯仿。α-乳糖和β-乳糖极易吸水,与一分子水结合后转变为一水合α-乳糖。乳糖受热时可燃烧,具有还原性,可还原斐林试剂和托伦试剂,在酸或酶的作用下可水解为半乳糖和葡萄糖,与碱共热可转化为乳果糖并分解为醛,还可与伯胺化合物发生美拉德缩合反应生成棕色产物。
基本信息
中文名
乳糖
英文名
Lactose, Milk Sugar, Lactobiose
别名
1,4-半乳糖苷葡萄糖
CAS编号
14641-93-1(α-乳糖);63-42-3(β-乳糖)
发现者
法布里齐奥·巴托莱蒂(Fabrizio Bartoletti, 1576-1630)
性质
化学式
C₁₂H₂₂O₁₁
结构式

摩尔质量
342.30 g/mol
外观
白色结晶粉末
气味
无特殊气味,有甜味
密度
1.547 g/cm³(20 ℃)(α-乳糖);1.59 g/cm³(20 ℃)(β-乳糖)
熔点
223 ℃(α-乳糖);252.2 ℃(β-乳糖)
溶解性
易溶于水,不溶于乙醇、乙醚、氯仿、甲醇(α-乳糖);易溶于水,微溶于乙醇,不溶于乙醚、氯仿(β-乳糖)
log P
-5.03(β-乳糖)
发现历史
1615年,意大利内科医生法布里齐奥·巴托莱蒂(Fabrizio Bartoletti, 1576-1630)首次发现了乳糖,他通过从牛奶中蒸发水分,然后反复溶解和凝固,分离出了一种白色盐状物质,便将其称作“牛奶乳清中的的盐(salt of milk whey)";1700年,威尼斯药剂师洛多维科·泰丝蒂(Lodovico Testi, 1640-1707)在他出版的书中也提到了乳糖,他称其为“saccharum lactis”;1780年,德国化学家卡尔·威廉·舍勒(Carl Wilhelm Scheele , 1742-1786)确认乳糖为一种糖类,并首次分离和表征了包括乳糖在内的许多有机化合物;1843年,法国化学家让·巴普蒂斯特·安德烈·大仲马(Jean Baptiste André Dumas, 1800-1884)将乳糖命名为“Lactose”,源于牛奶的拉丁语“Lac”,后缀-ose表示糖,该名沿用至今;1860年,法国化学家马赛兰·贝特洛(Marcellin Berthelot, 1827-1907)将乳糖命名为“milk sugar”;1894年,德国化学家埃米尔·菲舍尔(Emil Fischer, 1852-1919)提出乳糖具有α和β两种异构体。
天然来源
乳糖主要来源于哺乳动物的乳汁,且全部溶解于乳清中。乳糖在哺乳动物体内是由乳腺泌乳细胞合成的特有化合物,是维持渗透压的主要成分,其他器官无法合成。人乳中含乳糖5%-8%,牛乳中含乳糖4%-6%。牛乳中的甜味完全来自于乳糖。乳糖在乳中存在三种型态:α-乳糖、β-乳糖和少量醛型乳糖,绝大部以α-乳糖和β-乳糖两种同分异构体型态存在。此外,某些水果和连翘属植物的花粉管内也含有少量的乳糖。
分子结构
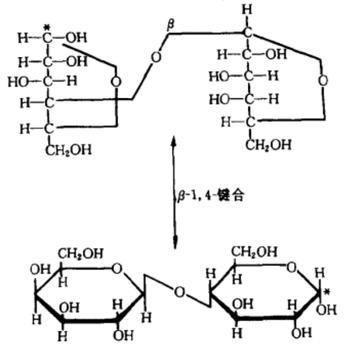
乳糖是由一分子D-葡萄糖和一分子D-半乳糖以β-1,4糖苷键结合而成的二糖。由于葡萄糖C₁位置上的-OH基和-H基结合位置不同,导致乳糖中的葡萄糖部分有α型和β型之分,而半乳糖部分都是β型,从而构成两个环糖反向异构体,含有α-D-(+)吡喃葡萄糖的称为α-乳糖,含有β-D-(+)吡喃葡萄糖的称为β-乳糖。α-乳糖和β-乳糖极易吸水,与一分子水结合后转变为一水合α-乳糖。一水合α-乳糖在真空中缓慢加热至100 ℃或在120-125 ℃迅速加热时可失去结晶水形成α-乳糖,用乙醇使一水合α-乳糖水合物脱水也可形成α-乳糖。
生理作用
乳糖可作人体热量的来源,1 g乳糖可生成16.72 kJ的热量,牛乳中的总热量的1/4都来自于乳糖。其GI指数(血糖指数)为46.0。乳糖进入人体后在胃中不被消化吸收,可直达肠道被小肠中的乳糖酶水解生成半乳糖和葡萄糖,半乳糖在酶催化下异构化为葡萄糖,经过代谢作用为人体提供能量。半乳糖还是构成脑及神经组织的糖脂质的种成分,能促进脑苷和黏多糖类的生成,对婴儿的智力发育十分重要。乳糖可在肠道中发酵产生乳酸,促进肠道乳酸杆菌繁殖,从而抑制肠道腐败菌繁殖、促进肠道蠕动,因此乳糖可以防治某些肠道疾病,乳酸的产生也可导致酸度增高,减少血氨,从而防治肝昏迷。乳糖还可促进肠道中钙、镁及铁等的吸收,防止佝偻病的发生。由于成年人体中乳糖酶活性较低,所以婴儿对乳糖吸收较好,成年人则较差。
理化性质
物理性质
乳糖外观呈白色结晶粉末,摩尔质量为342.30 g/mol,无特殊气味,具有甜味。α-乳糖的甜度约为蔗糖的15%,而β-乳糖较α-乳糖甜度更大。乳糖没有吸湿性,能把偏振光的振动平面向右旋转,具有右旋光性,用(+)表示。α-乳糖一水合物的比旋光度为+89.4°,α-乳糖为+86.0°,β-乳糖为+35.0°。α-乳糖易溶于水,不溶于乙醇、乙醚、氯仿、甲醇,β乳糖易溶于水,微溶于乙醇,不溶于乙醚、氯仿。α-乳糖溶于水后,会与β-乳糖互相转化,直至两者达到动态平衡为止,由于α-乳糖逐渐变为β-乳糖,而β-乳糖的溶解度比α-乳糖高,所以溶解度会随之上升直至平衡。此外,α-乳糖一水合物的的熔点为201-202 ℃,比热容为1.25 KJ(kg·℃)⁻¹;α-乳糖的密度为1.547 g/cm³,熔点为223 ℃;β-乳糖的密度为1.59 g/cm³,熔点为252.2 ℃,蒸气压为3.42×10⁻¹⁶ mmHg(25 ℃),比热容为1.21 KJ(kg·℃)⁻¹。
化学性质
乳糖受热时,会先熔融后膨胀,最后燃烧,过程伴有焦糖臭并遗留多量炭质。乳糖在酸或酶的作用下可水解生成半乳糖和葡萄糖,反应方程式如下。乳糖具有还原性,可还原斐林试剂和托伦试剂。乳糖可与伯胺化合物发生美拉德缩合反应,生成棕色产物。向乳糖的饱和水溶液中加入氢氧化钠溶液并加热,乳糖可转化为乳果糖,溶液呈黄色至红棕色;再加入硫酸铜试液,乳糖可分解为甲基乙二醛和甲醛等与硫酸铜反应生成氧化亚铜,产生红色沉淀。

制备方法
生物合成
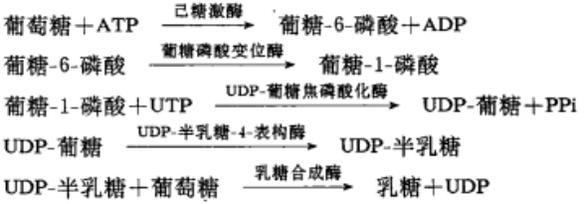
乳糖可在生物体内由葡萄糖合成。首先是葡萄糖的第6位磷酸化,再由变位酶催化使磷酰基从第6位转移到第1位,生成的葡糖-1-磷酸与尿喘啶核苷三磷酸(UTP)结合形成尿嘧啶核苷二磷酸葡糖(UDP-葡糖),同时释放出焦磷酸(PPi)。在表构酶催化下UDP-葡糖可以变为UDP-半乳糖,最后UDP-半乳糖在乳糖合成酶的存在下把半乳糖基转移给葡萄糖受体,在半乳糖的第1位碳原子和葡萄糖的第4位碳原子之间以β糖苷键相连接形成乳糖,同时释出UDP。反应机理如下:
实验室制法
乳糖在实验室中可以牛奶为原料提取。将新鲜脱脂牛奶加热,搅拌并加入稀醋酸溶液,静置,倾出上层清液,加入碳酸钙粉末以除去过量的醋酸。继续加热使蛋白质沉淀,抽滤后加入乙醇和活性炭,因乳糖不溶于乙醇,故当乙醇混入乳糖水溶液后可使乳糖结晶析出。乳糖结晶后滤出母液,经酒精洗涤后即得乳糖成品。
工业制法
乳糖的工业制法通常以干酪乳清为原料,采用结晶纯化的方法制得乳糖。首先将乳清离心,分离出脂肪和酪蛋白颗粒后,蒸发浓缩去除部分固形物,然后转移至结晶罐中,缓慢搅拌并降温使其冷却结晶。在93.5 ℃以下的水溶液中结晶干燥后可得α-乳糖,在93.5 ℃以上的水溶液中结晶干燥后可得β-乳糖。将结晶后的乳糖送入沉降式分离机使晶体分离出来在流化床上进行干燥,经碾磨和筛分达到理想粒度后包装即得成品。分离出乳糖后的乳清含有蛋白质,可作为饲料使用,或进一步脱盐作为脱脂乳的替代物使用。若制备药用级乳糖则需进一步纯化。将食用级乳糖继续溶于热水中,加入活性炭、磷酸盐和过滤物质后,泵入压滤机中再次结晶,经沉淀分离机进行分离、干燥,再经碾磨和筛分即得药用级乳糖。
应用领域
制药领域
乳糖可用于制药领域。因其不具有吸湿性,易压缩成形且与多数药物不起作用,所以可在片剂、散剂和胶囊剂生产中作填充剂和稀释剂,也可作直接压片的填充剂和赋形剂。乳糖作稀释剂在片剂生产过程中易于掌握,制成的片剂光洁美观。乳糖也可作载体或稀释剂应用于吸入剂和冻干制剂中,向冻干溶液中加入乳糖可增加其体积并有助于冻干块状物的形成。乳糖也可在药品生产中作甜味剂,或与蔗糖按比例混合制成糖衣。地塞米松片、增效左旋多巴、硝基甘油和消炎痛胶囊等药品中都有乳糖的存在。此外,乳糖也可在兽药中用作散剂、片剂和饲料添加剂的稀释剂,也可与可溶性药物配成溶液作动物(尤其家禽)饮水用。
食品工业领域
乳糖可用于食品工业领域。由于乳糖特殊的营养效果,所以可用于生产婴儿食品。中国GB 11674-2010《食品安全国家标准乳清粉和乳清蛋白粉》中规定,乳糖含量应≥61.0 g/hg;GB 10765-2010《食品安全国家标准婴儿配方食品》中规定,乳糖占碳水化合物总量应≥90%。此外,由于乳糖具有较强的吸附性,能够吸附气味和有色物质,所以可用作肉类食品风味和颜色的保存剂;乳糖易与蛋白质发生美拉德反应,添加于烘焙食品中可形成诱人的金黄色;一定比例的乳糖能消除糖果的甜腻感,所以可添加于蔗糖中用于生产糖果;乳糖可降低色素浓度,便于使用并降低贮藏期间的褪色,所以可用作粉状食品色素的吸附分散剂。乳糖还可用于生产人造奶油等食品,以防止结晶、降低甜度、防止粘结和增强香味等。
生物工程领域
乳糖可用于生物工程领域。其可用作培养基,如乳糖修饰的壳聚糖微载体,可用于培养肝细胞,因乳糖可与肝细胞膜上的无唾液酸糖蛋白受体作用,所以乳糖修饰的壳聚糖微载体更有利于肝细胞的贴附和生长。乳糖是乳糖操纵子的天然诱导物,因此可在大规模发酵诱导蛋白质的表达,生产重组蛋白,如诱导Monellin甜蛋白、蛛丝蛋白等。乳糖还可与蛋白质反应,弥补蛋白质结构的不稳定性,形成具有较好的乳化性、稳定性、抗氧化性等特性的蛋白质-乳糖复合物,如将乳糖与大豆蛋白反应,可提高其溶解性、乳化性、稳定性。此外,乳糖还可用于冷冻保存猪精液,对猪精子细胞膜起到保护作用。
化工领域
检测方法
氧化还原滴定法
乳糖可由氧化还原滴定法进行检测。试样经水洗后加入乙酸铅、草酸钾一磷酸氢二钠溶液,静置数分钟后用滤纸过滤,弃去初滤液并注入滴定管中。将斐林试剂加热至沸腾,滴入亚甲基蓝,用滤液滴定至蓝色完全褪尽即为终点,记录所用滤液体积,计算得乳糖含量。
其他方法
安全事宜
毒性
乳糖是天然食品,不具有毒性。
相关疾病
乳糖不耐受
乳糖不耐受是由于小肠中缺少乳糖酶或乳糖酶活性不够,不能将乳糖分解为葡萄糖和半乳糖,而乳糖作为一种二糖,不能直接被小肠吸收,所以大量不被吸收的乳糖在肠道中被细菌发酵,产生大量气体,从而引发腹部症状。乳糖不耐受分为四种类型,原发性乳糖不耐受、继发性乳糖不耐受、后天性乳糖不耐受和先天性乳糖不耐受。原发性乳糖不耐受是由于婴幼儿断奶后随年龄增长乳糖酶水平逐渐下降;继发性乳糖不耐受是由于小肠受损,如感染、肠炎等;后天性乳糖不耐受常见于早产儿中,可短时间内改善;先天性乳糖不耐受是由于先天乳糖产生的少或不产生,是遗传性疾病。乳糖不耐受最明显的症状是摄入牛奶或奶制品后出现腹部胀气、绞痛、腹泻、恶心、腹鸣和呕吐等,摄入的奶制品量越多,症状则越严重。
储存与贮运
乳糖应于干燥处密封储存。


